Leucemia Mieloide Crónica
La leucemia mieloide crónica (LMC) se conoce con varios otros nombres, entre ellos “leucemia granulocítica crónica” y “leucemia mielocítica crónica”.
La LMC surge como consecuencia de un cambio (mutación) en el ADN de una sola célula de la médula ósea. Esta mutación es “adquirida” (no está presente al nacer y no se contagia).
La célula mutada de la médula se multiplica en varias células (células de LMC). Las células de LMC proliferan y sobreviven mejor que las células normales; si no se tratan, con el tiempo superan en cantidad a las células normales. El resultado típico de la proliferación descontrolada de las células de LMC en la médula es un aumento de la cantidad de estas mismas células en la sangre. La LMC no interfiere completamente con el desarrollo de los glóbulos rojos, glóbulos blancos y plaquetas maduros. Como resultado, la leucemia mieloide crónica suele ser menos seria que la leucemia aguda.
Signos y síntomas:
Puede que las personas con LMC no tengan ningún síntoma en el momento del diagnóstico. Estas personas pueden ser diagnosticadas luego de un examen médico por otro problema o como parte de un chequeo periódico.
Los signos y síntomas de la LMC tienden a progresar gradualmente. Es posible que las personas con LMC:
- Se sientan cansadas y tengan dificultades para respirar al realizar las actividades cotidianas
- Tengan inflamación del bazo (la cual provoca una sensación de pesadez en la parte superior izquierda del abdomen)
- Estén pálidas debido a la anemia (una disminución de la cantidad de glóbulos rojos)
- Padezcan de sudores nocturnos.
- Incapacidad de tolerar temperaturas cálidas.
- Disminución de peso.
Diagnóstico y fases de la LMC:
Diagnóstico:
En la mayoría de los casos, se examinan las células de la sangre y la médula ósea para realizar un diagnóstico de la LMC. Se emplean varias pruebas de laboratorio para examinar la sangre y las células de la médula ósea, por ejemplo:
- Hemograma Completo: El hemograma mide la cantidad y los tipos de células en la sangre. Con la LMC, la concentración de hemoglobina disminuye y el conteo de glóbulos blancos aumenta, a menudo hasta niveles muy altos. El número de plaquetas puede aumentar o disminuir, dependiendo de la seriedad de la LMC de la persona. El examen de células sanguíneas coloreadas (tintadas) con un microscopio óptico muestra un patrón característico de los glóbulos blancos en las personas con LMC: una pequeña proporción de células inmaduras (células blásticas leucémicas y promielocitos) y una proporción mayor de glóbulos blancos en proceso de maduración y totalmente maduros (mielocitos y neutrófilos). Las células blásticas, los promielocitos y los mielocitos normalmente no están presentes en la sangre de personas sanas.
- Análisis citogenético: Esta prueba mide la cantidad y la estructura de los cromosomas. Se examinan muestras de la médula para confirmar los resultados de las pruebas de sangre y determinar si hay una anomalía cromosómica, como el cromosoma Philadelphia. Las pruebas de médula ósea, llamadas “aspiración de médula ósea” y “biopsia de médula ósea”, normalmente se realizan durante el mismo procedimiento. En una aspiración de médula ósea, se introduce una aguja especial por el hueso ilíaco hacia la médula para extraer una muestra líquida de células. Para una biopsia de médula ósea, se usa una aguja especial para extraer una muestra de hueso que contiene médula. Ambas muestras se examinan al microscopio para buscar cambios cromosómicos y otros cambios celulares. La presencia del cromosoma Ph (el cromosoma número 22 acortado) en las células de la médula, junto con un conteo alto de glóbulos blancos y otros resultados característicos de las pruebas de sangre y de médula, confirman el diagnóstico de LMC.
- Hibridación in situ con fluorescencia: (FISH, por sus siglas en inglés). Las células de la médula ósea en alrededor del 90 por ciento de las personas con LMC tienen cromosomas Ph detectables mediante el análisis citogenético. Un pequeño porcentaje de personas que presentan signos clínicos de LMC no tienen cromosomas Ph detectables por análisis citogenético, pero casi siempre tienen resultados positivos en cuanto al gen de fusión BCR-ABL en el cromosoma 22. La prueba FISH es un método más sensible para detectar la LMC que las pruebas citogenéticas convencionales que identifican el cromosoma Ph. FISH es una prueba cuantitativa que puede identificar la presencia del gen BCR-ABL. Los genes están formados por segmentos de ADN. La prueba FISH usa sustancias específicas que se unen al ADN para fragmentos seleccionados de ADN, en este caso, ABL y BCR. Las sondas para BCR y ABL se marcan con sustancias químicas que emiten, cada una, un color de luz diferente. El color se muestra en el cromosoma que contiene el gen (normalmente el cromosoma 9 para ABL y el cromosoma 22 para BCR), de modo que FISH puede detectar el fragmento del cromosoma 9 que se ha movido al cromosoma 22 en las células de LMC. Como la prueba FISH puede detectar el BCR-ABL en células que se encuentran en la sangre, puede usarse para determinar si hay una disminución importante en la cantidad de células de LMC circulantes como resultado del tratamiento para la CML.
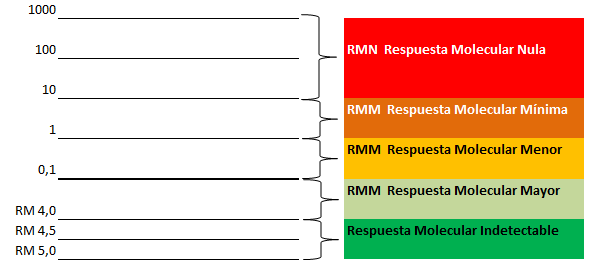
- Reacción en cadena de la polimerasa: (PCR, por sus siglas en inglés). El gen BCR-ABL también puede detectarse mediante análisis molecular. Una prueba cuantitativa de PCR es un método de análisis molecular que puede aplicarse a las células sanguíneas o de la médula ósea. Es la prueba más sensible para identificar y medir el gen BCR-ABL.
Básicamente, la prueba de PCR aumenta o “amplifica” pequeñas cantidades de fragmentos específicos de ARN o ADN, para que sea más fácil detectarlos y cuantificarlos. De este modo, la anomalía BCR-ABL puede detectarse incluso cuando está presente en un número muy bajo de células. Con la prueba PCR, se puede detectar aproximadamente una célula anormal en un millón de células. La prueba de PCR cuantitativa se usa para determinar la cantidad relativa de células con BCR-ABL en la sangre, y se ha convertido en el tipo más usado y relevante de prueba de PCR debido a su alto grado de sensibilidad y su capacidad para cuantificar el nivel de enfermedad presente.
- También es posible realizar conteos de células sanguíneas, exámenes de médula ósea, la prueba de FISH y la PCR para monitorizar la respuesta de una persona a la terapia. Durante todo el tratamiento, la cantidad de glóbulos rojos, glóbulos blancos, plaquetas y células de la LMC se mide periódicamente una vez comenzada la terapia.
Fases:
La LMC comprende tres fases. En la mayoría de los casos, la LMC se diagnostica en la fase “crónica”, aunque algunos pacientes se diagnostican en la fase “acelerada” y otros en “crisis blástica”. No obstante, una pequeña proporción de pacientes cuyo diagnóstico y tratamiento se realizan en la fase crónica de la LMC avanzan no obstante a la fase acelerada de la LMC. El avance desde la fase crónica, que normalmente puede controlarse eficazmente, hasta la fase acelerada o crisis blástica puede ser el resultado de alteraciones genéticas adicionales en las células madre leucémicas. Algunas de las anomalías cromosómicas adicionales pueden identificarse mediante análisis citogenético. No obstante, parece haber otros cambios genéticos en las células madre de la LMC que no pueden identificarse mediante las pruebas de laboratorio actualmente disponibles.
- Fase crónica: Las personas con LMC en fase crónica tal vez no tengan síntomas en esta fase, o los síntomas de la LMC pueden presentarse antes del tratamiento debido a cambios en los conteos de células sanguíneas o al aumento del tamaño del bazo. Los síntomas de la fase crónica, si es que se presentan, se resuelven rápidamente cuando las personas reciben tratamiento. Al inicio, una terapia eficaz reduce el conteo total de glóbulos blancos a niveles casi normales. La mejoría en el conteo de glóbulos blancos va acompañada por una reducción del tamaño expandido del bazo, una mejoría en la concentración de hemoglobina y el regreso de una sensación de bienestar. Los sangrados y complicaciones infecciosas no son comunes en la fase crónica. Una vez tratados, los pacientes con LMC en la fase crónica pueden retomar completamente sus actividades usuales.
- Fase acelerada: La anemia puede presentarse o progresar y causar fatiga, el conteo de glóbulos blancos puede disminuir hasta niveles muy bajos o elevarse debido a la acumulación de células blásticas y, por lo general, los conteos de plaquetas disminuyen. El conteo de células blásticas en la sangre y en la médula ósea suele aumentar durante la fase acelerada (y se eleva aún más en la crisis blástica). Es posible que el tamaño del bazo aumente; el paciente tal vez pierda su sensación de bienestar (en esta fase, es más frecuente que las personas se sientan enfermas), y puede que haya más complicaciones.
- Crisis blástica: En esta fase, la cantidad de células blásticas aumenta tanto en la médula ósea como en la sangre; los conteos de glóbulos rojos, plaquetas y neutrófilos generalmente pueden ser muy bajos, y es posible que el paciente sufra episodios de infección y sangrados como resultado. Otros síntomas que se observan comúnmente incluyen la fatiga, dificultad para respirar, dolor abdominal, dolor óseo o inflamación del bazo. Desafortunadamente, la crisis blástica es similar a la leucemia aguda en cuanto a sus efectos en el paciente. En aproximadamente el 25 por ciento de las personas, la transformación a la crisis blástica aparece como leucemia linfoblástica aguda, mientras que en la mayoría aparece como leucemia mieloide aguda.
Tratamiento:
La LMC no se puede curar totalmente con las farmacoterapias actuales, pero se han dado varios avances importantes en el tratamiento en años recientes y las opciones de tratamiento siguen evolucionando. Con las farmacoterapias actuales, la mayoría de las personas diagnosticadas con LMC en fase crónica pueden esperar vivir con una buena calidad de vida. Las metas de la investigación médica sobre la LMC son desarrollar terapias curativas y reducir los efectos secundarios del tratamiento. El enfoque del tratamiento para cada paciente es individualizado, basado en la fase de la LMC en el momento del diagnóstico, la edad del paciente (en particular cuando existe la posibilidad de un trasplante de células madre) y los resultados de las pruebas.
LMC en fase crónica. La meta en el tratamiento de las personas con LMC en fase crónica es restaurar los conteos sanguíneos hasta niveles normales, reducir drásticamente o eliminar completamente las células de LMC y mantener una calidad de vida aceptable. El tratamiento suele restaurar los conteos de células sanguíneas a valores normales y los mantiene en niveles normales o cerca de éstos (no es poco frecuente que ocurran reducciones leves de los conteos de células sanguíneas). El tamaño del bazo disminuye hasta que se aproxima a sus dimensiones normales. Las infecciones y los sangrados anormales son poco frecuentes. Los pacientes pueden volver a hacer sus actividades cotidianas. No obstante, deberán recibir chequeos médicos periódicos, incluyendo conteos de células sanguíneas y otras pruebas que determinen la extensión y la estabilidad de la remisión citogenética y molecular. Los exámenes periódicos de médula ósea son necesarios al principio del tratamiento, y a menudo se pueden hacer con menos frecuencia con el paso del tiempo; la observación de la respuesta al tratamiento mediante pruebas de sangre periódicas continúa en forma indefinida. Además, es necesario que se evalúen a las personas de vez en cuando para determinar su tolerancia a los fármacos, y como consecuencia quizás deban ajustarse las dosis.
IMATINIB: está indicado para el:
- Tratamiento de pacientes adultos y niños con leucemia mieloide crónica (LMC).
- Leucemia linfoblástica aguda con positividad del cromosoma Filadelfia (LLA Ph+ en pacientes adultos y pediátricos).
DASATINIB: se utiliza para tratar adultos:
- con leucemia mieloide crónica (LMC) con cromosoma Filadelfia positivo (Ph+) en fase crónica de diagnóstico reciente.
- adultos con LMC Ph+ y que ya no se beneficien o no toleren otros tratamientos, incluso con imatinib mesilato.
- adultos con leucemia linfoblástica aguda con cromosoma Filadelfia positivo (LLA Ph+) y que ya no se beneficien o no toleren otros tratamientos.
- niños con LMC Ph+ en fase crónica.
NILOTINIB: se usa en pacientes adultos y niños a partir de los 2 años de edad con:
- LMC recientemente diagnosticada.
- Pacientes con LMC que han dejado de obtener un beneficio terapéutico o que han padecido efectos secundarios graves con el tratamiento previo y ya no pueden continuar recibiendo dicho tratamiento.
BOSUTINIB: está indicado para el tratamiento de pacientes adultos con:
- Leucemia mieloide crónica con cromosoma Filadelfia positivo (LMC Ph+), en fase crónica (FC) recién diagnosticada
- LMC Ph+ en fase acelerada (FA) o fase blástica (FB), tratados previamente con uno o más inhibidores de la tirosina quinasa (ITK) y para quienes imatinib, nilotinib y dasatinib no se consideran opciones adecuadas de tratamiento.
PONATINIB: está indicado para el tratamiento de pacientes:
- adultos con Leucemia Mieloide Crónica (LMC) en sus fases crónica, acelerada o crisis blástica.
- adultos con Leucemia Linfoblástica Aguda (LLA) Ph+, para las cuales no está indicado ningún otro inhibidor de la tirosina quinasa.
- está indicado en el tratamiento de pacientes adultos con LMC T315i+ (en sus fases crónica acelerada o blástica); o Leucemia Linfoblástica Aguda (LLA) Ph+ T315i+
